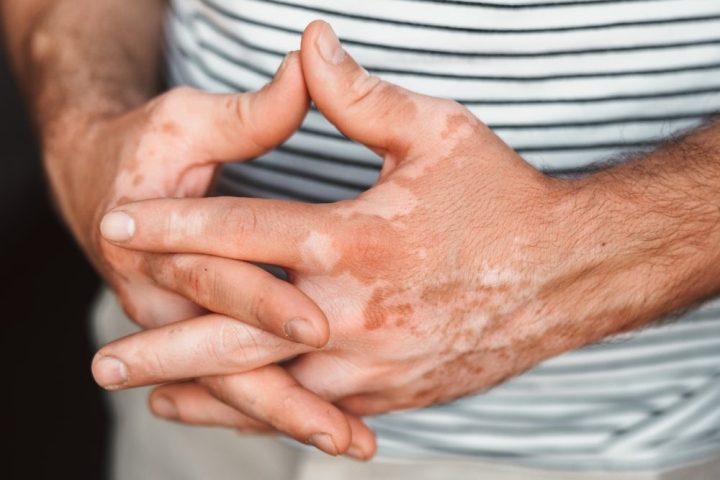
Компания AbbVie может получить восьмое показание для своего ведущего ингибитора янус-киназы (JAK) Rinvoq (упадацитиниб) после успешных результатов двух поздних стадий клинических испытаний при несегментарном витилиго (НСВ).
В исследованиях Viti-Up (NCT06118411) препарат достиг первичной конечной точки: 19,4% и 21,5% пациентов в первом и втором исследованиях соответственно показали 50-процентное уменьшение общей площади витилиго (T-VASI 50) по сравнению с исходным уровнем. Лечение Rinvoq также привело к улучшению показателей индекса площади витилиго на лице (F-VASI 75): 25,2% и 23,4% пациентов достигли 75-процентного очищения кожи лица от витилиго к 48-й неделе.
Кроме того, Rinvoq достиг вторичной конечной точки, демонстрируя 50-процентное очищение кожи лица от витилиго у 48,1% и 43,4% пациентов, получавших Rinvoq, в двух исследованиях соответственно.
С точки зрения безопасности, Rinvoq показал себя при НСВ аналогично другим одобренным показаниям. Наиболее частыми нежелательными явлениями, связанными с лечением, были назофарингит, инфекции верхних дыхательных путей и акне. Серьезные нежелательные явления наблюдались у 3,9% и 4% пациентов в группе Rinvoq, однако ни одно из них не было связано с серьезными сердечно-сосудистыми или венозными тромбоэмболическими событиями.
По словам Тьерри Пассерона, профессора и заведующего кафедрой дерматологии Университета Лазурного берега, эти результаты указывают, что «воздействие на лежащее в основе воспаление», связанное с НСВ, может предложить пациентам вариант лечения, который «помогает достигнуть видимых результатов».
Эти многообещающие результаты исследований Viti-Up следуют за двумя успешными исследованиями фазы III Rinvoq при очаговой алопеции, что побудило AbbVie подать заявку на одобрение препарата в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Оба этих исхода станут победой для AbbVie, которая теперь рассчитывает на свое портфолио иммунологических препаратов – в частности, Skyrizi (ризанкизумаб) и Rinvoq – чтобы компенсировать потерю продаж своего бестселлера Humira, который недавно утратил патентную защиту.
Для продления ценности Rinvoq, AbbVie недавно продлила эксклюзивность препарата на рынке на четыре года – до 2037 года. Американская фармацевтическая компания достигла этого, заключив соглашения с производителями дженериков, которые планировали коммерциализировать аналоги препарата к дате истечения его патента в 2033 году.
Если Rinvoq получит одобрение для лечения витилиго, он станет одним из двух таргетных препаратов, доступных на рынке. Топический ингибитор JAK Opzelura (руксолитиниб) от Incyte Corporation получил разрешение FDA в 2022 году. Аналитики GlobalData прогнозируют, что в случае получения одобрения Opzelura займет лидирующее положение на рынке по сравнению с Rinvoq. Прогнозируемые глобальные продажи препарата AbbVie при НСВ в 2031 году составят 562 млн долларов. Между тем, аналитики GlobalData оценивают, что Opzelura принесет глобальные продажи в размере 590 млн долларов только по показанию НСВ к 2031 году. Это, вероятно, объясняется топическим способом применения Opzelura, который удобнее для пациентов.
Rinvoq не является единственным пероральным ингибитором JAK, стремящимся занять долю на рынке НСВ. Препарат Litfulo (ритлецитиниб) компании Pfizer в настоящее время исследуется в рамках исследования фазы III Tranquillo (NCT05583526). Согласно ClinicalTrials.gov, это испытание планируется завершить в марте 2026 года. Вне показания НСВ, продажи Rinvoq, как ожидается, достигнут статуса «мегаблокбастера» к 2027 году, с пиком продаж в 15 млрд долларов в 2031 году.






